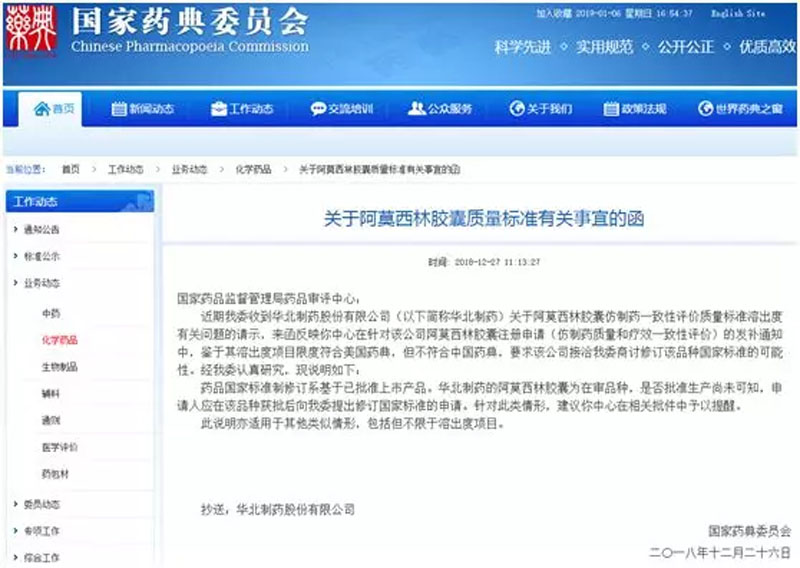
发稿时间:2019-01-14 来源:HPC药闻药事
最近,华北制药申报阿莫西林胶囊仿制药一致性评价,因其质量标准溶出度符合USP而不符合CP,国家药品监督管理局药品审评中心(CDE)要求企业与国家药典委员会(药典委)商讨修订该品种国家标准,药典委随后在其官网就这一问题致CDE。见下图。
CDE和药典委是在“踢皮球”还是“掐起来了”?
现就了解到的相关情况整理如下:
Q:药典委为什么要把这个回复函挂在网上?是否是为了向CDE“隔空喊话”?或者是要“怼CDE”?
A:药典委和CDE有良好的协调机制和沟通氛围,药典委给CDE的回复函其实更好地说明了这一点。把这样的一个“阳光文件”看做是药监局两个业务部门之间的扯皮是对实际情况不了解而造成的一个大大的误解或误读。
选择把这样一个问题挂在药典委官网上,是因为这样的问题不仅仅是华北制药会遇到,实际上近一年来,药典委多次接受类似情况咨询。药典委理解此类问题给企业带来的困扰和对CDE审评工作带来的不便。
我们希望通过将这个回复函向社会公开,让企业和药物研发机构更清楚地了解国家标准修订的程序。在品种被CDE批准前,药典委不会对该品种进行国家标准的修订工作。
有了这个公开函,华药知道该怎么做了,其他企业也不会再为了这样的情况困惑了,CDE的工作也方便了,药典委也无需逐一进行解释了。
Q:您认为一致性评价品种是否一定要符合现行版中国药典标准?
A:一致性评价品种在经过规范严格的生物等效性(BE)试验后,其质量和疗效得到了提升和保证,同时,包括溶出度在内的质量标准可能会有较大变化,新的注册标准应该服从于、服务于临床疗效和安全性。
在一致性评价工作开展前,很多的仿制药没有经过严格规范的BE试验,包括体外溶出释放等指标成为控制口服固体制剂的关键质量指标,包括中国药典在内的国家标准成为上市产品的最低质量要求,必须予以满足。
开展一致性评价以来,企业采用参比制剂进行药学研究和生物学等效试验,控制药品质量的注册标准会出现很多新的情况,如何制定科学合理的注册标准,CDE会按相应的审评指南严格把关。
Q:如何理解“药品国家标准制修订系基于已批准上市产品”?阿莫西林胶囊不就是已批准上市的产品吗?
A:一致性评价前批准的阿莫西林胶囊是已批准上市产品,在审评的一致性评价品种为在审品种,是否批准生产尚未可知。假如药典委根据某个企业在审评品种的某个项目而修改国家标准,后来因为种种原因,最后这个新申报的产品没有被批准。那我们修改中国药典的意义和依据将不复存在。
Q:假如华药阿莫西林胶囊某些指标按USP标准获批,将来是否会修订中国药典标准?