发稿时间:2020-10-28 来源: 医药网
医保局已经明确将适时开展生物类似药带量采购。生物类似药能否在我国临床市场上取代原研生物药,主要核心在三方面,一是医保支付,二是医院覆盖,三是医生处方。但对企业而言,能否赢得集采,关键还是价格。
01.生物类似药按集采“仿制药”管理?
2020年10月9日,国家医疗保障局对十三届全国人大三次会议第6450号建议的答复提到,“我局正在研究生物制品集中采购相关政策,生物类似药并非集中带量采购的禁区,在考虑生物类似药的相似性、企业产能和供应链的稳定性、具体产品的临床可替代性等因素的基础上,将适时开展集中带量采购”。
答复也提到,按照《关于将2019年谈判药品纳入乙类范围的通知》,“有效期限内如有其他生产企业的同通用名称药品(仿制药)上市,自动属于目录范围,医保部门有权根据仿制药价格调整医保支付标准,也有权将该通用名药品纳入集中采购范围。如修美乐(阿达木单抗)的仿制药已纳入医保支付范围”。这意味着生物类似药也被视为“仿制药”管理。
早在2017年3月,国家药典委员会发布关于对"生物制品通用名命名原则规程"征求意见的通知,规范生物制品通用名方法,生物类似药命名和原研无区别,为生物制品可以从通用名上取代原研药品打下基础。
我国在生物类似药的政策扶持稍显“迟到”,直到2017年12月,国家发改委发布《增强制造业核心竞争力三年行动计划(2018-2020年)》的通知,才明确首家生物类似药为高端药品。鼓励市场潜力大、临床价值高的专利到期,首家生物类似药的开发及产业化。
我国在研的生物类似药的靶点主要包括CD20、EFGR、VEGF、TNF、RANKL和HER2。涉及包括阿达木单抗、贝伐珠单抗、曲妥珠单抗、利妥昔单抗、依那西普、英夫利昔单抗、地舒单抗、非格司亭、培非格司亭、雷珠单抗、奥马珠单抗等近50个原研药物。
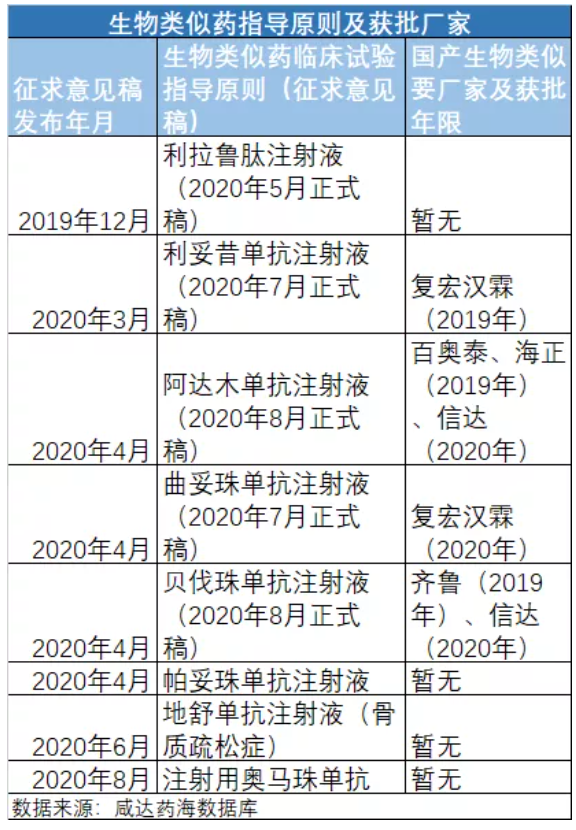
自2015年食品药品监管总局发布《生物类似药研发与评价技术指导原则(试行)》以来,2019年起终于发表了一系列具体产品的生物类似药临床试验设计指导原则。生物类似药临床试验设计指导原则主要针对的是生物类似药的上市标准。指导原则发布了,生物类似药获批的标准才有,生物类似药才有可能获批。
02.两个生物类似药具备集采条件
2019年以来,共有4个产品的生物类似药获批,分别是利妥昔单抗注射液、阿达木单抗注射液、曲妥珠单抗注射液和贝伐珠单抗注射液。利妥昔单抗注射液2019年已经转入医保常规目录。阿达木单抗注射液、曲妥珠单抗注射液和贝伐珠单抗注射液都在2019年谈判成功药品名单,这意味着上述三者的同通用名生物类似药都已纳入医保支付范围。
复宏汉霖和信达药业各有2个生物类似药获批,是国内目前获批生物类似药最多的厂家。阿达木单抗注射液(商品名:修美乐)和贝伐珠单抗注射液(商品名:安维汀)的生物类似药及原研厂家数已经到达集中采购的门槛——3家,理论上可以进行集中采购了。
2019年进入医保谈判目录的单抗类产品有康柏西普、阿柏西普、西妥昔单抗、贝伐珠单抗、尼妥珠单抗、曲妥珠单抗、帕妥珠单抗、信迪利单抗、阿达木单抗、英夫利西单抗、奥马珠单抗、雷珠单抗,除了康柏西普、西妥昔单抗、信迪利单抗和阿达木单抗有公布谈判价格外,其余产品皆无公布谈判价格。
医保谈判产品在医保谈判成功后由于价格已经明确,通常都是在采购平台挂网采购,生物类似药上市后也是挂网采购。但是不是所有生物类似药都能成功挂网采购。以湖北为例,《湖北省药品采购准入结果(第六批)》只有一家生物类似药,为齐鲁的贝伐珠单抗注射液,报价1198元,齐鲁2019年在其他省份的上市价格为1266元。《湖北省药品采购准入公示表(第七批)》提到信达进入挂网采购,但是没有公布信达的价格。
百奥泰的阿达木单抗注射液曾在天津报价1160元,在《湖北省药品采购准入结果(第六批)》没有成功挂网,《湖北省药品采购准入公示表(第七批)》的价格为1150元,有望成功挂网。

目前业界认为短期内最有可能集中采购的品类是胰岛素类生物制品。2020年1月9日,包括诺和诺德、礼来、通化东宝、联邦制药等10家胰岛素生产企业参与了武汉市的带量采购招标会,这是胰岛素第一次被纳入集中采购的品类范围。按胰岛素起效时间分为7组进行议价后,仅有诺和诺德、江苏礼来及通化东宝、合肥天麦入围。预计市场主要由诺和诺德、礼来和通化东宝三家瓜分。武汉模式非常有可能是作为试点模式而被全国借鉴。
03.生物类似药集中采购的难点是什么?
生物类似药能否取代原研产品,医保局明确了需要考虑的是生物类似药的相似性、企业产能和供应链的稳定性、具体产品的临床可替代性等因素的基础上,将适时开展集中带量采购。
2020年8月,CDE发布了关于公开征求《生物类似药相似性评价和适应症外推技术指导原则(征求意见稿)》,其提到的“相似性”是指:生物类似药与参照药之间高度相似,在纯度、安全性及有效性不存在有临床意义的差别。整体相似性评价需要根据药学、非临床及临床比对试验结果综合评价,如候选药和参照药微小的质量差异未发现对安全性、有效性和免疫原性等存在影响的,则可以认为候选药与参照药整体相似。实际上这些研究基本上在注册申报的时候都需要开展,因此从相似性考虑,基本上都可以替代。
目前对生物类似药临床用药的可互换性的主要担忧来自于安全性:不少利益相关方认为互换生物类似药可能增加不同的免疫原性反应和不良反应,影响患者用药安全。与此同时,也有越来越多的证据表明生物类似药不良反应是由于药物配方之间的差异以及不适当的贮存和运输条件造成的,药物之间的互换不会增加免疫原性反应。欧盟更是在指南中指出,通过10年的临床证据表明,EMA批准的生物类似药可以作为其他生物制剂在其所有批准的适应证中安全有效地使用。
日前,国际仿制药协会呼吁精简全球生物类似药开发和审批流程。其中,上文提及的证明“相似性”方面的研究,特别是证明比对临床疗效的要求在生物类似药的整体监管评价和决策过程中的价值有限。文件中引用了一项回顾性研究,研究显示欧盟和美国批准的所有生物类似药开发计划的比对疗效研究均得出了比对疗效的确证性结果。
在95% 的生物类似药开发计划中,比对疗效研究没有为审评过程增加任何科学价值。在剩余 5% 的计划中,建立了比对疗效,但在免疫原性率上存在差异,在批准之前需要改进生产工艺。重要的是,这些结果是在 2010 年之前开发的生物类似药中观察到的,此后在生物类似药开发计划中,未观察到临床疗效和安全性(包括免疫原性)方面的差异。尽管比较临床疗效研究在监管决策中价值有限,但“监管机构很少免除对这些研究的需求。”
药品之间可以互换是指将一种药物替换成预期具有相同临床效果的另一种药物,这意味着可用生物类似药替换原研药品 (反之亦然)或用某种生物类似药替换另一种生物类似药。可互换的生物类似药包括下述属性:1)生物类似药是原研生物药的类似物;2)生物类似药预期在任何患者身上产生与原研药同样的临床效果;3)和生物类似药在同一患者效果递减的风险不比原研药更高。4)可互换的生物类似药可以不经医生的干预就可以与原研药互换。
美国认为生物类似药的可互换性可能就要补充试验:生物仿制药与原研生物药之间的两次或更多次的替换是否影响治疗过程的安全性或疗效。临床试验如何设计,真实世界数据的研究是否可以作为佐证,一切都还是在摸索中。生物类似药上市所需要做的3期临床研究成本就很高,如果还需要做可互换性试验来论证可行性,无疑是为生物类似药的使用再加多一道门槛,这种门槛主要利好的是原研厂家。
生物类似药能否互换,在临床用药上通常有转换和替代2种形式。
转换形式指的是处方医生决定用某种具有相同治疗目的的一种药物替换另一种药物,也包括了集中采购政策或临床供应等客观原因,对临床医生的处方自由构成管理限制,从而发生的转换。集中采购如果将生物类似药纳入名单,这意味着生物类似药有望从临床供应上完成和原研的转换。
替代形式是指不咨询处方医生的情况下,在药房终端分配同通用名的生物制品时原研药品和生物类似药之间的替代,自动替代在化学仿制药是常见的,但是生物类似药由于其特殊性,目前用药指导原则没有认可自动替代。
04.价格战会到来吗?
生物类似药能否在我国临床市场上取代原研生物药,主要核心在三方面,一是医保支付,二是医院覆盖,三是医生处方。
国家医疗保障局对十三届全国人大三次会议第6450号建议的答复明确了按通用名确定的医保目录以及对应的医保药品支付标准中,生物类似药和原研药品属于同通用名,理论上可以相互替换。
生物制品特别是生物类似药如果可以集中采购,生物类似药可以在中标省份医疗机构取代原研药品。
医生处方方面,2020年5月15日,由中国临床肿瘤学会(CSCO)中国抗淋巴瘤联盟主办的中国生物类似药专家共识发布会成功举行,北京大学肿瘤医院朱军教授、上海交通大学附属瑞金医院沈志祥教授、哈尔滨血液病肿瘤研究所所长马军教授与中国医学科学院肿瘤医院石远凯教授担任本次会议主席。会上正式发布了首部《中国生物类似药专家共识》。从共识来看,目前主要由处方医生决定了患者是否可以转换生物类似药,由于生物类似药的用药积累经验不足,预计前期仍然是个性化药物治疗为主。
无论是从医保政策还是集中采购、临床用药指南,都为生物类似药在临床上取代原研药提供依据。随着我国生物类似药的产品的陆续获批,生物类似药的价格战也不远了。
