发稿时间:2021-08-04 来源: 医药网
根据美国食品和药物管理局(FDA)的数据统计,2021年7月FDA共批准4款创新药物,全部为新分子实体。2021年至今,美国FDA已陆续批准了33款创新药物,其中25款为新分子实体,6款为新生物制品,剩余2款为细胞疗法。
近十年FDA批准的新药数量
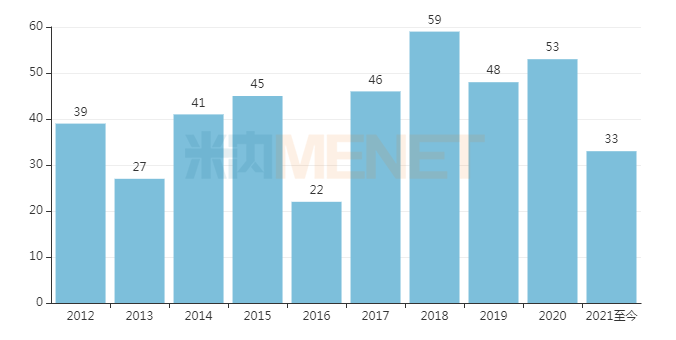
来源:FDA网站、公开资料
2021年7月,美国FDA共计批准的4款创新药物,涉及多个疾病领域,包括首款用于治疗糖尿病慢性肾病的非甾体选择性盐皮质激素受体拮抗剂Kerendia(finerenone);首款用于治疗布氏冈比亚锥虫引起的非洲锥虫病的口服药物Fexinidazole(fexinidazole);美国FDA批准的首款也是唯一一款ROCK2小分子抑制剂Rezurock(belumosudil),以及全球首款获得监管批准治疗进展性家族性肝内胆汁淤积的药物Bylvay(odevixibat)。
7月的4款创新药物中,除了在我国发病率极低的非洲锥虫病的治疗药物fexinidazole以外,其余3款新药均已在CDE进行注册申报。其中,finerenone(非奈利酮)已经处于申请生产阶段,而belumosudil片由烨辉医药引入,目前正在进行2期临床试验;Albireo Pharma公司的odevixibat在2020年末获得了CDE临床试验默示许可。
近年,越来越多的创新原研药加快进入中国市场的步伐,这一方面是因为国家对于创新原研药进入国内是持鼓励态度的,研发企业能够享受到各种政策红利;另一方面是随着国内经济水平不断上升,中国医药市场空间大潜力足的优势越发明显,国外创新原研企业越来越重视中国市场。
FDA批准新药的详细信息
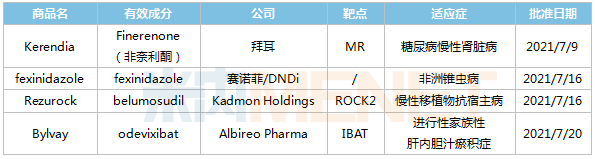
来源:FDA网站、米内网全球药物研发库
Kerendia(finerenone)
2021年7月9日,美国FDA批准了拜耳公司的Kerendia(finerenone,非奈利酮)上市,用于在伴有慢性肾脏病(CKD)的2型糖尿病患者中,降低肾衰竭风险、延缓估算肾小球滤过率(eGFR)的下降速度,降低心血管死亡、非致死性心肌梗塞,以及因为心力衰竭住院的风险。Kerendia是首款用于治疗糖尿病慢性肾脏病的非甾体选择性盐皮质激素受体(MR)拮抗剂。此前,Kerendia曾获得FDA授予的快速通道资格认定,此次申请也是通过优先审查途径获得批准。目前,该药也正在国内接受NMPA的监管审查。
finerenone具体信息
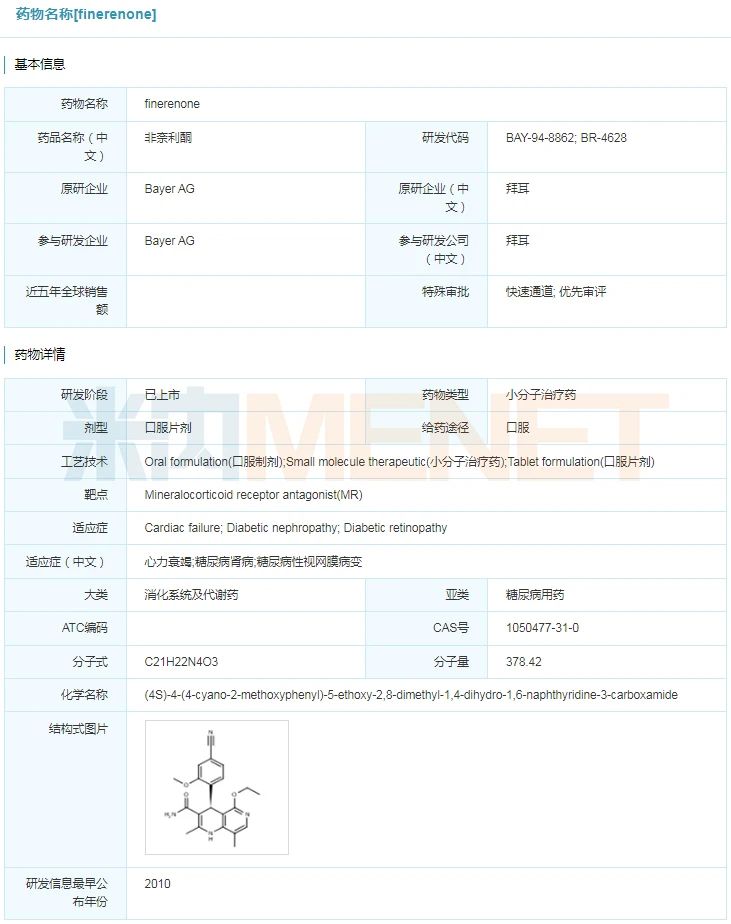
来源:米内网全球药物研发库
在美国,糖尿病是慢性肾病和肾衰竭的主要原因。当肾脏受损并且不能正常过滤血液时,就会发生慢性肾脏疾病。由于过滤有缺陷,患者还可能会出现与体液、电解质和体内废物堆积相关的并发症。慢性肾病有时会发展为肾功能衰竭,患者也有患心脏病的高风险。在中国,糖尿病慢性肾脏病已经超过了肾小球肾炎相关慢性肾脏病,成为我国慢性肾脏病的首要病因。
此次批准主要基于名为FIDELIO-DKD的关键性3期临床试验,该试验入组了来自全球48个国家约5700例糖尿病慢性肾脏病的患者。结果显示,与安慰剂相比,Kerendia将首次出现肾衰竭风险、延缓估算肾小球滤过率(eGFR)在至少4周内从基线水平持续降低≥40%,肾脏死亡的复合风险显著降低了18%,心血管死亡、非致命性心肌梗塞、非致命性中风或心力衰竭住院时间的复合风险降低了14%。
Fexinidazole(fexinidazole)
2021年7月16日,赛诺菲和DNDi共同开发的fexinidazole(fexinidazole)获得美国FDA批准,用于治疗布氏冈比亚锥虫引起的非洲锥虫病(HAT,又称为昏睡病)。fexinidazole是用于昏睡病的首款直接口服治疗方法,该药不仅适用于疾病第一阶段,而且适用于寄生虫穿过血脑屏障导致患者出现神经精神症状的疾病第二阶段。此前,fexinidazole已获得美国FDA授予的优先审评和孤儿药资格认定。
belumosudil具体信息
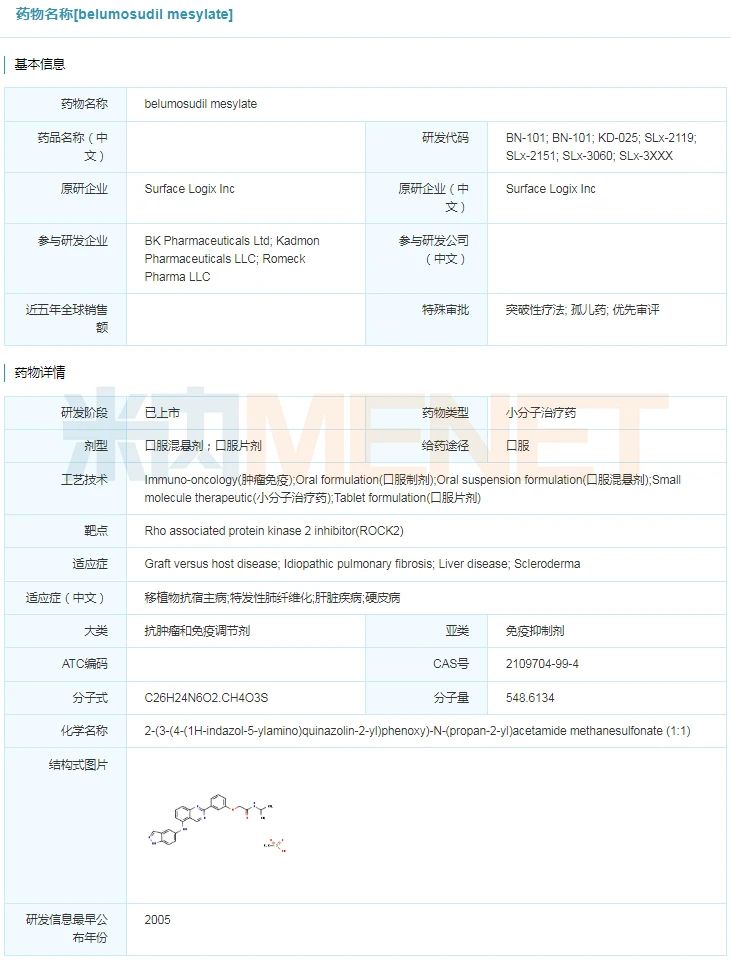
来源:米内网全球药物研发库
异基因造血干细胞移植是目前治疗造血系统恶性肿瘤、某些遗传性及骨髓衰竭性疾病的重要手段,慢性移植物抗宿主病是异基因造血干细胞移植后晚期并发症中最为常见的一种。在异基因造血干细胞移植后存活半年以上的病人中有30%-50%会出现慢性移植物抗宿主病。它是一种全身性,累及多器官的综合症,类似自身免疫性疾病。
Rezurock在一项随机、开放标签、多中心关键2期临床试验中的优越表现为此次批准奠定基础。名为ROCKstar的临床试验共入组了65名先前已接受过至少2次、最多5次的全身治疗失败的慢性移植物抗宿主病患者。研究结果显示,接受Rezurock治疗的患者达到75%的总缓解率(ORR),其中完全缓解率为6%,部分缓解率为69%。中位缓解持续时间为1.9个月。而首次出现缓解反应的中位时间为1.8个月,62%应答患者在缓解后至少12个月内不需要新的全身性疗法。
Bylvay(odevixibat)
7月20日,Albireo Pharma公司宣布美国FDA批准其研发的Bylvay(odevixibat)上市,用于治疗所有亚型的进展性家族性肝内胆汁淤积(PFIC)所引起皮肤瘙痒。Bylvay是全球首款获得监管批准治疗进展性家族性肝内胆汁淤积的药物。此前,Bylvay已获得FDA授予的孤儿药、快速通道和优先审评等资格认定。
odevixibat具体信息/b>
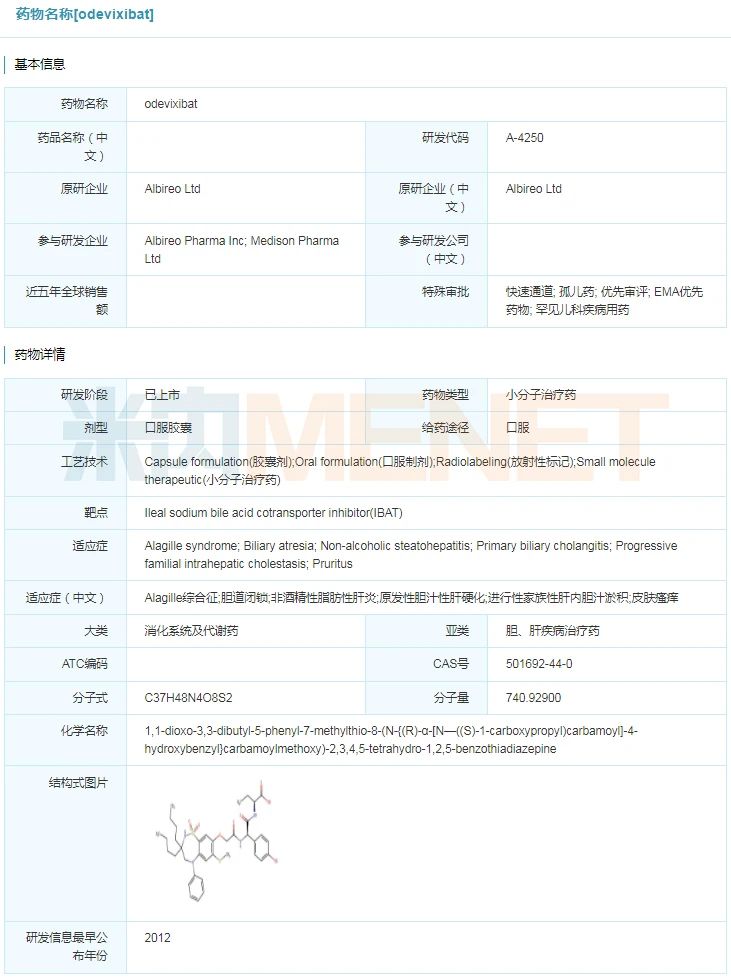
来源:米内网全球药物研发库
进展性家族性肝内胆汁淤积(PFIC)是一种罕见的遗传性疾病,因基因突变肝细胞难以产生和分泌胆汁,发生肝细胞内胆汁积聚,会导致肝细胞损伤,并可能发展为更为严重的肝脏疾病。世界范围内,每5万至10万个新生儿中,约有一个会受PFIC的影响。此前,进展性家族性肝内胆汁淤积患者的唯一选择是肝移植或其他侵入性手术,没有获批的药物可治疗PFIC。
Bylvay的安全性和有效性在PEDFIC-1和PEDFIC- 2两项全球性3期临床试验中得到验证。在随机双盲、含安慰剂对照的PEDFIC-1研究中, Bylvay治疗组显著降低了胆汁酸反应,显著改善了皮肤瘙痒,且耐受性良好,腹泻/排便频繁的发生率很低。在长期、开放标签3期扩展研究PEDFIC-2中,数据重申了Bylvay的强劲疗效,研究结果显示,在治疗长达48周的患者中,胆汁酸反应持续和持久地减少、瘙痒评估得到改善、肝脏和生长功能指标令人鼓舞。
